Неорганическая химия
Строение электронных оболочек атомов и ионов элементов первых четырех периодов.
А1(2004 г., 38%) Восьмиэлектронную внешнюю оболочку имеет ион
1) P3+ 2) S2- 3) Cl5+ 4) Fe3+
При определении электронного строения иона надо учитывать, что при образовании иона атом отдает или принимает определенное число электронов. В данном случае: фосфор, элемент 5-й группы, на внешнем слое 5 электронов (3s23p3). У иона P3+ (P0 - 3е = P3+) на внешнем слое останется 2 электрона (3s23p0). Cера, элемент 6-й группы, на внешнем слое 6 электронов (3s23p4), у иона (S0 + 2е = S2-) их будет 8 (3s23p6). Строение иона хлора рассматривается аналогично. Железо – это d-элемент, на внешнем уровне атома железа, как и у большинства d-элементов, 2 электрона (3s23p63d64s2). При образовании иона (Fe0 - 3е = Fe3+), именно эти 2 электрона теряются в первую очередь, кроме того могут уходить электроны предыдущего d-подуровня. Внешним для иона железа становится третий уровень, на котором остается 13 электронов (3s23p63d54s0). Правильный ответ: 2.
Характерные химические свойства неорганических веществ различных классов: неметаллов, оснований, амфотерных гидроксидов, солей.
A9 (2004г, 7%) Верны ли следующие суждения о неметаллах?
А. В периодической системе неметаллы расположены в правой, преимущественно верхней части.
Б. Среди неметаллов нет ни одного d- элемента.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
Возможно, причина столь низкого балла для этого вопроса – его сложная конструкция, встречающаяся сравнительно редко, и, вероятно, мало отработанная школьниками при подготовке. Правильный ответ: 3.
Свойства оксидов и гидроксидов, особенно амфотерных, продолжают оставаться трудным материалом в области неорганической химии:
А13 (2005, 32%) Гидроксид цинка реагирует с каждым из двух веществ:
1) НС1 и MgSO4
2) NaOH и H2SO4
3) NaOH и KNO3
4) MgCl2 и HNO3
Правильный ответ 2.
A15 (2005г, 17%) Карбонат натрия не реагирует с
1) гидроксидом бария 2) гидроксидом калия
3) серной кислотой 4) углекислым газом
Наиболее сложным для школьников, вероятно, было определить возможность реакции карбоната натрия в присутствии воды с углекислым газом, приводящей к образованию гидрокарбоната. В то же время не всем очевидно, что реакция обмена между карбонатом натрия и гидроксидом калия не протекает. Правильный ответ 2.
Вопрос конечно не безупречен, поскольку не отмечено, что речь идет о растворе карбоната, а в отсутствии воды правильными будут ответы и 2, и 4.
Достаточно сложными являются для школьников вопросы, относящиеся к закономерностям протекания химической реакции. Так, затруднение вызвал казалось бы несложный вопрос:
А24 (2005, 34%) Под скоростью химической реакции понимают изменение
1) концентрации реагента в единицу времени
2) количества вещества реагента в единицу времени
3) количества вещества реагента в единице объема
4) количества вещества продукта в единице объема
Ошибки, возможно, вызваны тем определением скорости реакции, которое иногда дается, как изменение «количества вещества в единице объема в единицу времени». Но изменение количества вещества в единице объема есть изменение концентрации (Dn/V=Dc).
Правильный ответ: 1.
Затруднения вызвали и вопросы, связанные с изменением скорости химической реакции:
А24 (2005, 46%) Для увеличения скорости реакции
4Fe(тв.) + 3О2(газ) = 2Fe2O3(тв) + Q следует
1) уменьшить температуру
2) увеличить температуру
3) уменьшить концентрацию кислорода
4) увеличить количество железа
А23 (2004, 23%) Для увеличения скорости реакции
2AgNO3(тв) = 2Ag(тв) + 3O2(г) + 2NO2(г) - 157 кДж необходимо
1) увеличить концентрацию AgNO3
2) уменьшить давление в системе
3) увеличить степень измельченности AgNO3
4) уменьшить температуру
Факторами, влияющими на скорость химической реакции являются:
- природа веществ;
- температура;
- концентрации исходных веществ;
- давления газообразных исходных веществ;
- наличие катализатора.
Для гетерогенных реакций добавляются такие факторы, как:
- величина поверхности, связанная обычно со степенью измельченности вещества;
- наличие (интенсивность) перемешивания.
Увеличение любого из этих факторов (кроме природы веществ) приводит к увеличению скорости химической реакции.
Для первого вопроса сразу определяем правильный ответ 2, поскольку увеличение температуры наиболее общий фактор, влияющий на скорость реакции. Поскольку реакция гетерогенная, увеличение количества вещества железа, если оно не связано с увеличением поверхности, не приводит к увеличению скорости реакции.
Вторая реакция тоже гетерогенная, и среди предложенных ответов есть степень измельчения вещества. Чем больше степень измельчения, тем больше поверхность твердого вещества, тем больше скорость реакции. Другие перечисленные воздействия либо не влияют на скорость данной реакции (1 и 2), либо приведут к ее уменьшению (4). Правильный ответ: 3.
Возможные причины ошибок: школьники не учитывают гетерогенность системы и выбирают первый ответ; школьники путают факторы, смещающие равновесие (ответ 2), и факторы, влияющие на скорость реакции.
Как уже отмечалось, в 2004 году наиболее трудными оказались вопросы, посвященные энергетике химической реакции, например:
A24 (2004г, 22%) Экзотермической является реакция
1) MgCO3 = MgO + CO2
2) Fe2O3 + 2Al = 2Fe + Al2O3
3) C + CO2 = 2CO
4) 2CH4 = C2H2 + 3H2
Обычно школьники не имеют четких критериев определения знака теплового эффекта по уравнению реакции, не умеют связывать его с устойчивостью веществ, самопроизвольностью процесса. Можно рекомендовать следующие правила:
а) если реакция протекает самопроизвольно при обычных условиях, она скорее всего экзотермическая (но для начала реакции может потребоваться инициация). Так, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая;
б) для устойчивых веществ реакции их образования из простых веществ экзотермические, реакции разложения – эндотермические.
в) если в ходе реакции из менее устойчивых веществ образуются более устойчивые, реакция экзотермическая.
В данном случае экзотермической является реакция алюмотермии, которая после предварительного поджигания протекает самопроизвольно, с выделением такого большого количества тепла, что образующееся железо плавится. Правильный ответ: 2
Трудными, особенно для участников 2-й волны 2005 года были вопросы, посвященные реакциям ионного обмена.
A27 (2004г, 12,2%) Взаимодействию сульфата меди и сероводорода отвечает сокращенное ионное уравнение:
1) Cu2+ + Н2S = CuS + 2Н+
2) CuSO4 + 2Н+ = Cu2+ + Н2SO4
3) CuSO4 + S2– = CuS + SO42–
4) Cu2+ + S2– = CuS
Молекулярное уравнение реакции: CuSO4 + Н2S = CuS + Н2SO4
Из участвующих в реакции веществ сильными электролитами является сульфат меди (растворимая соль) и серная кислота (сильная кислота). Эти вещества должны быть записаны в виде ионов. Н2S (слабая кислота) и CuS (нерастворим) ионов в растворе практически не образуют, и должны записываться целиком. Правильный ответ: 1.
Типичная ошибка школьников – определять способность вещества распадаться на ионы только по таблице растворимости. Думается, по этой причине многие выбрали ответ 4.
Один из трудных вопросов по теме «Химическое равновесие»:
A25 (2005г, 49%) В системе СН3СООН + СН3ОН « СН3СООСН3 + Н2О
смещению химического равновесия в сторону образования сложного эфира будет способствовать
1) добавление метанола
2) повышение давления
3) повышение концентрации эфира
4) добавление гидроксида натрия
Поскольку реакция этерификации проводится в жидком состоянии, давление не будет влиять на положение равновесия. Повышение концентрации эфира, продукта реакции смещает равновесие в сторону исходных веществ. Ученик должен понимать и действие гидроксида натрия. Хотя непосредственно в обратимой реакции он не участвует, но может взаимодействовать с уксусной кислотой, снижать ее концентрацию, смещать равновесие влево.Правильный ответ: 1.
Среди заданий по органической химии следует обратить внимание на вопросы, посвященные строению органических веществ:
A19(2005, 57%) В молекуле пропина атом углерода при тройной связи образует:
1) 4 s-связи 2) 2 s- и 2 p-связи
3) 3 s- и p-связь 4) 1 s- и 3 p-связи
Число s-связей определяется числом соседних атомов. Из структурной формулы пропина Н-С#С-СН3, видно, что каждый атом углерода при тройной связи имеет два соседних атома, а значит образует 2 s-связи. Атом углерода четырехвалентен и образует еще две p-связи.Правильный ответ: 2.
Реакции, характеризующие основные свойства и способы получения углеводородов, были представлены, например, таким вопросом:
A30 (2005, 47%) Для получения бутена-2 из 2-бромбутана следует использовать
1) водный раствор серной кислоты
2) водный раствор гидроксида калия
3) спиртовой раствор гидроксида калия при нагревании
4) никелевый катализатор
Для ответа школьник должен знать различное действие спиртового и водного раствора щелочи на алкилгалогениды. Правильный ответ: 3.
Трудными для школьников были вопросы по механизмам реакций замещения и присоединения в органической химии.
А31 (2004, 19,6%) При взаимодействии бутина-1 с водой в присутствии солей ртути образуется преимущественно
1) бутанол-1 2) бутанол-2 3) бутаналь 4) бутанон
В указанных условиях происходит присоединение молекулы воды к алкину, с последующей перегруппировкой с образованием более устойчивого карбонильного соединения. Присоединение воды протекает с учетом правила Марковникова:
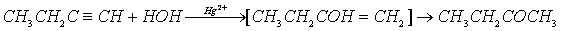
Правильный ответ: 4
Вопрос достаточно сложный, так как для ответа необходимо понимать смысл реакции Кучерова, применять правило Марковникова, да еще знать номенклатуру практически не изучаемых в школе кетонов.
Недостаточно уверенно школьники ориентируются и в свойствах кислородсодержащих органических соединений, например:
А20 (2005, 39%) С раствором NaOH не реагирует вещество, формула которого
1) С6Н5СООН 2) С6Н5ОН 3) С2Н5СООН 4) С2Н5ОН
Два вещества содержат карбоксильную группу, относятся к классу карбоновых кислот, их сразу отбрасываем. Два оставшихся соединения содержат гидроксильную группу, причем одно из них фенол, другое – спирт. В отличие от фенолов, спирты практически не обладают кислотными свойствами и не реагируют с растворами щелочей. Правильный ответ: 4.
Экзамен 2004 года показал, что школьники плохо знают такое свойство спиртов, как способность образовывать простые эфиры:
А16 (2004, 14,4%) Этанол взаимодействует с
1) метанолом 2) бромной водой 3) водородом 4) медью
В формулировку этого вопроса следовало бы, вероятно, включить слова: “при подходящих условиях”. Если просто прилить к метанолу этанол, то реакции, разумеется, не произойдет. Но при нагревании спиртов в присутствии серной кислоты возможна реакция межмолекулярной дегидратации. Если взята смесь метанола и этанола, образуется (наряду с диметиловым и диэтиловым эфиром) метилэтиловый эфир:
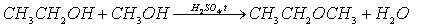
Правильный ответ: 1.
А17(2004, 32,3%) Олеиновая кислота совмещает в себе свойства карбоновой кислоты и
1) амина 2) алкена 3) алкина 4) спирта
Органическое соединение может совмещать свойства разных классов веществ, если имеет несколько функциональных групп.
Олеиновая кислота имеет формулу: СН3-(СН2)7-СН=СН-(СН2)7-СООН
Поэтому наряду со свойствами кислоты она проявляет свойства алкена. Правильный ответ: 2.
Для выпускников 2004 года оказались сложными задания, посвященные классификации углеводов, например:
А19 (2004, 13,3%) Верным является высказывание
1) глюкоза – это пятиатомный альдегидоспирт
2) фруктоза – это шестиатомный спирт
3) крахмал – это полисахарид, состоящий из остатков фруктозы
4) сахароза – это дисахарид, состоящий из двух молекул глюкозы
Вероятно, при изучении углеводов мало внимание обращается на их отнесение к определенным классам веществ, поэтому термины “альдегидоспирт, оксикислота, кетоноспирт” мало знакомы выпускникам. Глюкоза, С6Н12О6, содержит альдегидную и 5 гидроксильных функциональных групп, следовательно, это пятиатомный альдегидоспирт.
Правильный ответ: 1.
Трудными, особенно для участников второй волны 2005 года были вопросы по реакциям, характеризующие основные свойства и способы получения азотсодержащих соединений.
А32 (2005, 39%) Метиламин реагирует с каждым из двух веществ:
1) O2 и N2 2) FeCl2 и NH3 3) НС1 и NaCl 4) Н2O и H2SO4
Аналогично аммиаку, амины реагируют с водой, образуя неустойчивые гидраты, в данном случае гидроксид метиламмония. Также для аминов характерно взаимодействие с кислотами. Правильный ответ: 4.
Кроме того, школьники должны были знать, что при горении аминов образуется азот, особенностях взаимодействия анилина с бромной водой, а также об амфотерных свойствах аминокислот:
А31 (2004, 32%) Амфотерными свойствами обладает
1) метиламин 2) глицин 3) анилин 4) фенол
Правильный ответ: 2.
Примером задания на правила обращения с веществами и оборудованием служит вопрос:
А31 (2005, 46%) В оцинкованном сосуде нельзя хранить раствор
1) Na2SO4 2) MgCl2 3) С2Н5ОН 4) СН3СООН
Школьник должен понимать, что нельзя использовать сосуды, материал которых может реагировать с раствором. В данном случае, правильный ответ: 4.
На протяжении всех трех лет проведения ЕГЭ трудными для школьников остаются вопросы, посвященные химическому производству. Вопросы могут относиться к сырью, особенностям отдельных стадий процесса, используемым аппаратам или получаемым продуктам:
А34 (2005, 35%) Сырье для получения метанола в промышленности служат
1) СН3Cl и NaOH 2) HCHO и H2 3) CO и Н2 4) НCOOH и NaOH
Сырье для промышленного производства должно быть максимально дешевым и доступным (в отличие от лабораторных способов получения веществ, где главное – мягкие условия проведения реакции и хороший выход). Правильный ответ: 3.
А34 (2005, 22%) В производстве серной кислоты для поглощения оксида серы (VI) используют
1) Н2О 2) H2SO3 3) Н2SО4(конц.) 4) Н2SО4(разб)
Использование концентрированной серной кислоты позволяет избежать образования трудно улавливаемого тумана из капелек серной кислоты в газовой фазе. Правильный ответ: 3.
А34 (2004, 16,8%) Из каменноугольной смолы получают
1) этанол 2) кокс 3) бензол 4) бензин
Каменноугольную смолу (как и кокс) получают при коксовании каменного угля. Каменноугольная смола содержит значительное число ароматических соединений, в том числе и бензола. Правильный ответ: 3.
Г.М. Можаев
старший преподаватель
ТюмГУ, химический факультет;
ТОГИРРО
| 




